Niacine
Auteur:
Vivian Patrick
Date De Création:
14 Juin 2021
Date De Mise À Jour:
10 Août 2025

Contenu
- Probablement efficace pour...
- Peut-être efficace pour...
- Inefficace pour...
- Preuves insuffisantes pour évaluer l'efficacité de...
- Précautions particulières et mises en garde :
Ne pas confondre niacine avec NADH, niacinamide, nicotinate d'inositol, IP-6 ou tryptophane. Voir les listes séparées pour ces sujets.
Les formes de prescription de niacine sont approuvées par la Food and Drug Administration (FDA) des États-Unis pour l'hypercholestérolémie et pour augmenter les niveaux d'un type spécifique de bon cholestérol, connu sous le nom de HDL. Les suppléments de niacine et les produits sur ordonnance sont également pris par voie orale pour prévenir les carences en vitamine B3 et les affections connexes telles que la pellagre.
Base de données complète de médecines naturelles évalue l'efficacité sur la base de preuves scientifiques selon l'échelle suivante : Efficace, Probablement efficace, Peut-être efficace, Peut-être inefficace, Probablement inefficace, Inefficace et Preuves insuffisantes pour évaluer.
Les cotes d'efficacité pour NIACINE sont les suivants:
Probablement efficace pour...
- Taux anormaux de cholestérol ou de lipides sanguins (dyslipidémie). Certains produits à base de niacine sont approuvés par la Food and Drug Administration (FDA) des États-Unis en tant que produits de prescription pour le traitement des taux anormaux de graisses dans le sang. Ces produits de niacine sur ordonnance sont généralement offerts à des concentrations élevées de 500 mg ou plus. Les formes de compléments alimentaires de niacine sont généralement dosées à 250 mg ou moins. Étant donné que des doses très élevées de niacine sont nécessaires pour améliorer le taux de cholestérol, le complément alimentaire niacine n'est généralement pas approprié. La niacine peut être associée à d'autres médicaments hypocholestérolémiants lorsque le régime et la monothérapie ne suffisent pas. La niacine améliore les taux de cholestérol, mais n'améliore pas les résultats cardiovasculaires tels que les crises cardiaques et les accidents vasculaires cérébraux.
- Une maladie causée par une carence en niacine (pellagre). La niacine est approuvée par la Food and Drug Administration (FDA) des États-Unis pour cet usage. Cependant, la niacine peut provoquer des « rougeurs » (rougeurs, démangeaisons et picotements). Ainsi, un autre produit, appelé niacinamide, est parfois préféré car il ne provoque pas cet effet secondaire.
Peut-être efficace pour...
- Taux anormaux de lipides sanguins chez les personnes vivant avec le VIH/sida. La prise de niacine semble améliorer les taux de cholestérol et de lipides sanguins appelés triglycérides chez les patients atteints de cette maladie.
- Un groupe de symptômes qui augmentent le risque de diabète, de maladie cardiaque et d'accident vasculaire cérébral (syndrome métabolique). La prise de niacine semble augmenter les taux de lipoprotéines de haute densité (HDL ou « bon ») cholestérol et réduire les taux de lipides sanguins appelés triglycérides chez les personnes atteintes du syndrome métabolique. Prendre de la niacine avec un acide gras oméga-3 sur ordonnance semble fonctionner encore mieux.
Inefficace pour...
- Cardiopathie. Des recherches de haute qualité montrent que la niacine ne prévient pas les crises cardiaques ou les accidents vasculaires cérébraux chez les personnes qui prennent de la niacine pour prévenir ou traiter les maladies cardiaques. Il n'a pas non plus été démontré que la niacine réduisait le risque de décès. La niacine ne doit pas être prise pour traiter ou prévenir les maladies cardiaques.
Preuves insuffisantes pour évaluer l'efficacité de...
- Durcissement des artères (athérosclérose). La prise de niacine par voie orale avec des médicaments appelés chélateurs des acides biliaires pourrait réduire le durcissement des artères chez les hommes atteints de cette maladie. Il semble fonctionner mieux chez les hommes ayant des taux élevés de graisses sanguines appelées triglycérides. Mais la prise de niacine ne semble pas réduire le durcissement des artères chez les patients atteints d'une maladie appelée maladie artérielle périphérique (MAP). De plus, la niacine ne prévient pas les événements cardiovasculaires tels qu'une crise cardiaque ou un accident vasculaire cérébral.
- maladie d'Alzheimer. Les personnes qui consomment des quantités plus élevées de niacine dans les aliments et les multivitamines semblent avoir un risque plus faible de contracter la maladie d'Alzheimer que les personnes qui consomment moins de niacine. Mais rien ne prouve que la prise d'un supplément de niacine aide à prévenir la maladie d'Alzheimer.
- Cataractes. Les personnes qui ont une alimentation riche en niacine pourraient avoir un risque réduit de développer des cataractes nucléaires. La cataracte nucléaire est le type de cataracte le plus courant. L'effet de la prise de suppléments de niacine est inconnu.
- Une infection des intestins qui provoque la diarrhée (choléra). La prise de niacine par voie orale semble réduire la diarrhée chez les personnes atteintes de choléra.
- Dysfonction érectile (DE). La prise de niacine à libération prolongée au coucher pendant 12 semaines semble aider les hommes souffrant de dysfonction érectile et de taux élevés de lipides à maintenir une érection pendant les rapports sexuels.
- Taux élevés de phosphate dans le sang (hyperphosphatémie). Les personnes souffrant d'insuffisance rénale peuvent avoir des taux sanguins élevés de phosphate. Certaines recherches préliminaires montrent que la prise de niacine peut réduire les taux sanguins de phosphate chez les personnes atteintes d'insuffisance rénale terminale et des taux élevés de phosphate sanguin. Mais d'autres recherches montrent que la prise de niacine n'abaisse pas les taux de phosphate sanguin chez les personnes qui prennent également des médicaments utilisés pour abaisser les taux de phosphate sanguin.
- Blocage de la veine dans l'œil (occlusion veineuse rétinienne): Les premières recherches montrent que la prise de niacine pourrait améliorer la vue chez les personnes atteintes de cette maladie.
- Drépanocytose: Les premières recherches montrent que la prise de niacine n'améliore pas les taux de lipides sanguins chez les personnes atteintes de drépanocytose.
- Acné.
- Trouble de la consommation d'alcool.
- Performance athlétique.
- Trouble déficitaire de l'attention avec hyperactivité (TDAH).
- Dépression.
- Vertiges.
- Hallucinations induites par la drogue.
- Migraine.
- Mal des transports.
- Schizophrénie.
- D'autres conditions.
La niacine est absorbée par le corps lorsqu'elle est dissoute dans l'eau et prise par voie orale. Il est converti en niacinamide s'il est pris en quantités supérieures à ce dont le corps a besoin.
La niacine est nécessaire au bon fonctionnement des graisses et des sucres dans le corps et au maintien de cellules saines. À fortes doses, la niacine pourrait aider les personnes atteintes de maladies cardiaques en raison de ses effets bénéfiques sur la coagulation. Il peut également améliorer les niveaux d'un certain type de graisse appelée triglycérides dans le sang.
Une carence en niacine peut provoquer une maladie appelée pellagre, qui provoque une irritation de la peau, de la diarrhée et une démence. La pellagre était courante au début du XXe siècle, mais elle l'est moins maintenant, car certains aliments contenant de la farine sont maintenant enrichis en niacine. La pellagre a été pratiquement éliminée dans la culture occidentale.
Les personnes ayant une mauvaise alimentation, l'alcoolisme et certains types de tumeurs à croissance lente appelées tumeurs carcinoïdes pourraient être à risque de carence en niacine. Lorsqu'il est pris par voie orale: la niacine est PROBABLEMENT SR pour la plupart des gens lorsqu'ils sont pris de manière appropriée. Les produits sur ordonnance contenant de la niacine sont sans danger lorsqu'ils sont pris conformément aux instructions. Les aliments contenant de la niacine ou les suppléments de niacine sont sans danger lorsqu'ils sont pris à des doses inférieures à 35 mcg par jour.
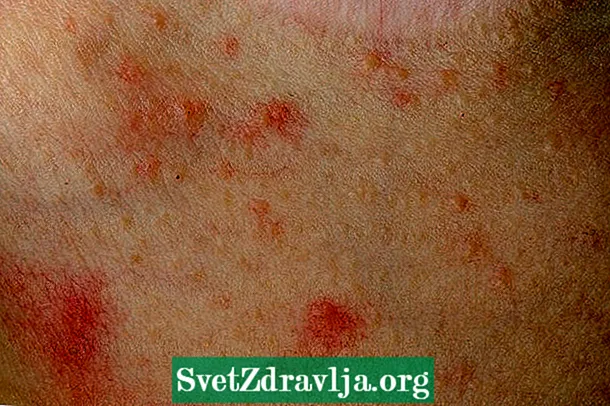
Un effet secondaire courant de la niacine est une réaction de bouffée de chaleur. Cela peut provoquer des brûlures, des picotements, des démangeaisons et des rougeurs du visage, des bras et de la poitrine, ainsi que des maux de tête. Commencer par de petites doses de niacine et prendre 325 mg d'aspirine avant chaque dose de niacine aidera à réduire les bouffées vasomotrices. Habituellement, cette réaction disparaît à mesure que le corps s'habitue au médicament. L'alcool peut aggraver la réaction de bouffée de chaleur. Évitez de grandes quantités d'alcool lorsque vous prenez de la niacine.
D'autres effets secondaires mineurs de la niacine sont des maux d'estomac, des gaz intestinaux, des étourdissements, des douleurs dans la bouche et d'autres problèmes.
Lorsque des doses de plus de 3 grammes par jour de niacine sont prises, des effets secondaires plus graves peuvent survenir. Ceux-ci incluent des problèmes de foie, la goutte, des ulcères du tube digestif, une perte de vision, une glycémie élevée, un rythme cardiaque irrégulier et d'autres problèmes graves.
Précautions particulières et mises en garde :
La grossesse et l'allaitement: la niacine est PROBABLEMENT SR pour les femmes enceintes et allaitantes lorsqu'il est pris par voie orale dans les quantités recommandées. La quantité maximale recommandée de niacine pour les femmes enceintes ou allaitantes est de 30 mg par jour pour les femmes de moins de 18 ans et de 35 mg pour les femmes de plus de 18 ans.Enfants: la niacine est PROBABLEMENT SR lorsqu'il est pris par voie orale dans les quantités recommandées pour chaque groupe d'âge. Mais les enfants doivent éviter de prendre des doses de niacine supérieures aux limites supérieures quotidiennes, qui sont de 10 mg pour les enfants de 1 à 3 ans, 15 mg pour les enfants de 4 à 8 ans, 20 mg pour les enfants de 9 à 13 ans et 30 mg pour les enfants de 14 à 18 ans.
Allergies: La niacine pourrait aggraver les allergies en provoquant la libération d'histamine, le produit chimique responsable des symptômes allergiques.
Maladie cardiaque/angine instable: De grandes quantités de niacine peuvent augmenter le risque de rythme cardiaque irrégulier. Utiliser avec précaution.
maladie de Crohn: Les personnes atteintes de la maladie de Crohn peuvent avoir de faibles niveaux de niacine et nécessiter une supplémentation pendant les poussées.
Diabète: La niacine peut augmenter la glycémie. Les personnes diabétiques qui prennent de la niacine doivent vérifier attentivement leur glycémie.
Maladie de la vésicule biliaire: La niacine pourrait aggraver la maladie de la vésicule biliaire.
Goutte: De grandes quantités de niacine peuvent provoquer la goutte.
Maladie du rein: La niacine peut s'accumuler chez les personnes atteintes d'une maladie rénale. Cela pourrait causer des dommages.
Maladie du foie: La niacine pourrait augmenter les dommages au foie. N'utilisez pas de grandes quantités si vous souffrez d'une maladie du foie.
Ulcères d'estomac ou intestinaux: La niacine pourrait aggraver les ulcères. N'utilisez pas de grandes quantités si vous avez des ulcères.
Tension artérielle très basse: La niacine pourrait abaisser la tension artérielle et aggraver cette condition.
Chirurgie: La niacine peut interférer avec le contrôle de la glycémie pendant et après la chirurgie. Arrêtez de prendre de la niacine au moins 2 semaines avant une intervention chirurgicale programmée.
Dépôts graisseux autour des tendons (xanthomes tendineux): La niacine pourrait augmenter le risque d'infections dans les xanthomes.
Troubles thyroïdiens: La thyroxine est une hormone produite par la glande thyroïde. La niacine pourrait abaisser les taux sanguins de thyroxine. Cela pourrait aggraver les symptômes de certains troubles thyroïdiens.
- Modérer
- Soyez prudent avec cette combinaison.
- Alcool (Éthanol)
- La niacine peut provoquer des bouffées vasomotrices et des démangeaisons. La consommation d'alcool avec de la niacine peut aggraver les bouffées vasomotrices et les démangeaisons. On craint également que la consommation d'alcool avec de la niacine augmente le risque d'endommager le foie.
- Allopurinol (Zyloprim)
- L'allopurinol (Zyloprim) est utilisé pour traiter la goutte. La prise de fortes doses de niacine peut aggraver la goutte et diminuer l'efficacité de l'allopurinol (Zyloprim).
- Clonidine (Catapres)
- La clonidine et la niacine abaissent toutes deux la tension artérielle. La prise de niacine avec de la clonidine peut entraîner une baisse de votre tension artérielle.
- Gemfibrozil (Lopid)
- La prise de niacine avec le gemfibrozil peut causer des dommages musculaires chez certaines personnes. Utiliser avec précaution.
- Médicaments pour le diabète (médicaments antidiabétiques)
- L'utilisation de fortes doses de niacine (environ 3 à 4 grammes par jour) peut augmenter la glycémie. En augmentant la glycémie, la niacine pourrait diminuer l'efficacité des médicaments contre le diabète. Surveillez de près votre glycémie. La dose de votre médicament contre le diabète devra peut-être être modifiée.
Certains médicaments utilisés pour le diabète comprennent le glimépiride (Amaryl), le glyburide (DiaBeta, Glynase PresTab, Micronase), l'insuline, la pioglitazone (Actos), la rosiglitazone (Avandia), la metformine (Glucophage), le natéglinide (Starlix), le répaglinide (Prandin), le chlorpropamide ( Diabinèse), glipizide (Glucotrol), tolbutamide (Orinase) et autres. - Médicaments pour l'hypertension artérielle (médicaments antihypertenseurs)
- L'utilisation de niacine avec des médicaments qui abaissent la tension artérielle peut augmenter les effets de ces médicaments et peut trop abaisser la tension artérielle.
Certains médicaments contre l'hypertension artérielle comprennent le captopril (Capoten), l'énalapril (Vasotec), le losartan (Cozaar), le valsartan (Diovan), le diltiazem (Cardizem), l'amlodipine (Norvasc), l'hydrochlorothiazide (HydroDIURIL), le furosémide (Lasix) et bien d'autres. . - Médicaments pouvant nuire au foie (médicaments hépatotoxiques)
- La niacine peut endommager le foie. Les préparations de niacine à libération prolongée semblent présenter le plus grand risque. Prendre de la niacine avec des médicaments qui pourraient également nuire au foie peut augmenter le risque de dommages au foie. Ne prenez pas de niacine si vous prenez un médicament qui peut endommager le foie.
Certains médicaments qui peuvent nuire au foie comprennent l'acétaminophène (Tylenol et autres), l'amiodarone (Cordarone), la carbamazépine (Tegretol), l'isoniazide (INH), le méthotrexate (Rheumatrex), la méthyldopa (Aldomet), le fluconazole (Diflucan), l'itraconazole (Sporanox), érythromycine (érythrocine, ilosone, autres), phénytoïne (Dilantin), lovastatine (Mevacor), pravastatine (Pravachol), simvastatine (Zocor) et bien d'autres. - Médicaments qui ralentissent la coagulation du sang (Anticoagulants / Antiplaquettaires)
- La niacine pourrait ralentir la coagulation du sang. Prendre de la niacine avec des médicaments qui ralentissent également la coagulation peut augmenter les risques d'ecchymoses et de saignements.
Certains médicaments qui ralentissent la coagulation du sang comprennent l'aspirine, le clopidogrel (Plavix), la daltéparine (Fragmin), l'énoxaparine (Lovenox), l'héparine, l'indométacine (Indocin), la ticlopidine (Ticlid), la warfarine (Coumadin) et d'autres. - Médicaments utilisés pour abaisser le cholestérol (chélateurs des acides biliaires)
- Certains médicaments pour abaisser le cholestérol, appelés chélateurs des acides biliaires, peuvent diminuer la quantité de niacine absorbée par le corps. Cela pourrait réduire l'efficacité de la niacine. Prenez la niacine et les médicaments à au moins 4 à 6 heures d'intervalle.
Certains de ces médicaments utilisés pour abaisser le cholestérol comprennent la cholestyramine (Questran) et le colestipol (Colestid). - Médicaments utilisés pour abaisser le cholestérol (Statines)
- La niacine peut nuire aux muscles. Certains médicaments utilisés pour réduire le cholestérol, appelés statines, peuvent également affecter les muscles. La prise de niacine avec ces médicaments peut augmenter le risque de problèmes musculaires.
Certains de ces médicaments utilisés pour l'hypercholestérolémie comprennent la rosuvastatine (Crestor), l'atorvastatine (Lipitor), la lovastatine (Mevacor), la pravastatine (Pravachol), la fluvastatine (Lescol) et la simvastatine (Zocor). - Probénécide (Benemid)
- Le probénécide est utilisé pour traiter la goutte. La prise de fortes doses de niacine peut aggraver la goutte et diminuer l'efficacité du probénécide.
- Sulfinpyrazone (Anturane)
- La sulfinpyrazone (Anturane) est utilisée pour traiter la goutte. La prise de fortes doses de niacine peut aggraver la goutte et diminuer l'efficacité de la sulfinpyrazone (Anturane).
- L'hormone thyroïdienne
- Le corps produit naturellement des hormones thyroïdiennes. La niacine pourrait diminuer les niveaux d'hormones thyroïdiennes. Prendre de la niacine avec des pilules d'hormones thyroïdiennes pourrait diminuer les effets et les effets secondaires de l'hormone thyroïdienne.
- Mineur
- Soyez prudent avec cette combinaison.
- Aspirine
- L'aspirine est souvent utilisée avec la niacine pour réduire les bouffées vasomotrices causées par la niacine. La prise de fortes doses d'aspirine peut diminuer la vitesse à laquelle le corps se débarrasse de la niacine. Cela pourrait entraîner une trop grande quantité de niacine dans le corps et éventuellement entraîner des effets secondaires. Cependant, les faibles doses d'aspirine les plus couramment utilisées pour les bouffées vasomotrices liées à la niacine ne semblent pas être un problème.
- Patch à la nicotine (Nicoderm)
- La niacine peut parfois provoquer des bouffées vasomotrices et des étourdissements. Le timbre de nicotine peut également provoquer des bouffées vasomotrices et des étourdissements. La prise de niacine ou de niacinamide et l'utilisation d'un timbre à la nicotine peuvent augmenter le risque de rougeurs et de vertiges.
- Bêta-carotène
- Une combinaison de niacine et du médicament d'ordonnance simvastatine (Zocor) augmente le cholestérol HDL (lipoprotéines de haute densité) (« bon cholestérol ») chez les personnes atteintes de maladie coronarienne et de faibles taux de HDL. Cependant, la prise de niacine avec des combinaisons d'antioxydants, y compris le bêta-carotène, semble atténuer cette augmentation du HDL. On ne sait pas si cet effet se produit chez les personnes qui n'ont pas de maladie coronarienne.
- Chrome
- La prise de niacine et de chrome ensemble pourrait abaisser la glycémie. Si vous souffrez de diabète et que vous prenez des suppléments de chrome et de niacine ensemble, surveillez votre glycémie pour vous assurer qu'elle ne descende pas trop bas.
- Herbes et suppléments qui pourraient nuire au foie
- La niacine, surtout à des doses plus élevées, peut endommager le foie. La prise de niacine avec d'autres herbes ou suppléments qui pourraient nuire au foie pourrait augmenter ce risque. Certains de ces produits comprennent l'androstènedione, la feuille de bourrache, le chaparral, la consoude, la déhydroépiandrostérone (DHEA), la germandrée, le kava, l'huile de menthe pouliot, la levure rouge et autres.
- Herbes et suppléments qui pourraient abaisser la tension artérielle
- La niacine pourrait abaisser la tension artérielle. Prendre de la niacine avec d'autres herbes et des suppléments qui abaissent également la tension artérielle peut entraîner une baisse excessive de la tension artérielle. D'autres herbes et suppléments qui peuvent abaisser la tension artérielle comprennent l'andrographis, les peptides de caséine, la griffe de chat, la coenzyme Q10, la L-arginine, le lycium, l'ortie, la théanine et autres.
- Herbes et suppléments qui pourraient ralentir la coagulation du sang
- La niacine pourrait ralentir la coagulation du sang. L'utilisation de niacine avec d'autres herbes et suppléments qui ralentissent également la coagulation du sang peut augmenter le risque de saignement chez certaines personnes. Certaines autres herbes de ce type comprennent l'angélique, le clou de girofle, le danshen, l'ail, le gingembre, le Panax ginseng et d'autres.
- Thé Kombucha
- On craint que le thé kombucha ne diminue l'absorption de la niacine. Cependant, cela doit être étudié davantage.
- Sélénium
- Une combinaison de niacine et du médicament d'ordonnance simvastatine (Zocor) augmente le cholestérol HDL (lipoprotéines de haute densité) (« bon cholestérol ») chez les personnes atteintes de maladie coronarienne et de faibles taux de HDL. Cependant, la prise de niacine avec des combinaisons d'antioxydants, dont le sélénium, semble atténuer cette augmentation du HDL. On ne sait pas si cet effet se produit chez les personnes qui n'ont pas de maladie coronarienne.
- Tryptophane
- Certains tryptophane de l'alimentation peuvent être convertis en niacine dans le corps. La prise de niacine et de tryptophane ensemble pourrait augmenter les niveaux et les effets secondaires de la niacine.
- Vitamine C
- Une combinaison de niacine et du médicament d'ordonnance simvastatine (Zocor) augmente le cholestérol HDL (lipoprotéines de haute densité) (« bon cholestérol ») chez les personnes atteintes de maladie coronarienne et de faibles taux de HDL. Cependant, la prise de niacine avec des combinaisons d'antioxydants, dont la vitamine C, semble atténuer cette augmentation du HDL. On ne sait pas si cet effet se produit chez les personnes qui n'ont pas de maladie coronarienne.
- Vitamine E
- Une combinaison de niacine et du médicament d'ordonnance simvastatine (Zocor) augmente le cholestérol HDL (lipoprotéines de haute densité) (« bon cholestérol ») chez les personnes atteintes de maladie coronarienne et de faibles taux de HDL. Cependant, la prise de niacine avec des combinaisons d'antioxydants, y compris la vitamine E, semble atténuer cette augmentation du HDL. On ne sait pas si cet effet se produit chez les personnes qui n'ont pas de maladie coronarienne.
- Zinc
- Le corps peut fabriquer de la niacine. Les personnes souffrant de malnutrition et présentant une carence en niacine, comme les alcooliques chroniques, produisent de la niacine supplémentaire si elles prennent du zinc. Il pourrait y avoir un risque accru d'effets secondaires liés à la niacine tels que des bouffées vasomotrices et des démangeaisons si la niacine et le zinc sont pris ensemble.
- Boissons chaudes
- La niacine peut provoquer des bouffées vasomotrices et des démangeaisons. Ces effets peuvent être accrus si la niacine est prise avec une boisson chaude.
ADULTES
PAR LA BOUCHE:
- Général: Certains produits de compléments alimentaires mentionnent la niacine sur l'étiquette en équivalents niacine (NE). 1 mg de niacine équivaut à 1 mg de NE. Lorsque la niacine est répertoriée sur une étiquette en tant que NE, elle peut également inclure d'autres formes de niacine, notamment la niacinamide, le nicotinate d'inositol et le tryptophane. Les apports nutritionnels quotidiens recommandés (AJR) pour la niacine chez l'adulte sont de 16 mg NE pour les hommes, 14 mg NE pour les femmes, 18 mg NE pour les femmes enceintes et 17 mg NE pour les femmes allaitantes.
- Pour un taux de cholestérol élevé:Les effets de la niacine sont dose-dépendants. Des doses de niacine aussi faibles que 50 mg et aussi élevées que 12 grammes par jour ont été utilisées. Cependant, les augmentations les plus importantes du HDL et les diminutions des triglycérides se produisent entre 1 200 et 1 500 mg/jour. Les plus grands effets de la niacine sur le LDL se produisent à 2000 à 3000 mg/jour. La niacine est souvent utilisée avec d'autres médicaments pour améliorer le taux de cholestérol.
- Pour prévenir et traiter la carence en vitamine B3 et les affections apparentées telles que la pellagre: 300-1000 mg par jour en doses fractionnées.
- Pour traiter le durcissement des artères: Les doses de niacine ont atteint jusqu'à 12 grammes par jour. Cependant, une dose d'environ 1 à 4 grammes de niacine par jour, seule ou avec des statines ou des chélateurs des acides biliaires (un médicament hypocholestérolémiant), a été utilisée jusqu'à 6,2 ans.
- Pour réduire la perte de liquide causée par la toxine cholérique: 2 grammes par jour ont été utilisés.
- Pour les taux anormaux de graisses dans le sang dus au traitement du VIH/SIDA: Jusqu'à 2 grammes par jour ont été utilisés.
- Pour le syndrome métabolique: 2 grammes de niacine ont été pris quotidiennement pendant 16 semaines. Dans certains cas, 2 grammes de niacine par jour, seuls ou à ce dosage, sont pris avec 4 grammes d'esters éthyliques d'oméga-3 sur ordonnance (Lovaza, GlaxoSmithKline Pharmaceuticals).
- Pour prévenir et traiter la carence en vitamine B3 et les affections apparentées telles que la pellagre: 60 mg de niacine ont été utilisés.
- Pour prévenir et traiter la carence en vitamine B3 et les affections apparentées telles que la pellagre: 60 mg de niacine ont été utilisés.
PAR LA BOUCHE:
- Général: Les apports nutritionnels quotidiens recommandés (AJR) pour la niacine chez les enfants sont de 2 mg NE pour les nourrissons de 0 à 6 mois, 4 mg NE pour les nourrissons 7-12 mois, 6 mg NE pour les enfants 1-3 ans, 8 mg de NE pour les enfants de 4 à 8 ans, 12 mg de NE pour les enfants de 9 à 13 ans, 16 mg de NE pour les garçons de 14 à 18 ans et 14 mg de NE pour les filles de 14 à 18 ans.
- Pour prévenir et traiter la carence en vitamine B3 et les affections apparentées telles que la pellagre: 100-300 mg par jour de niacine, administrés en doses fractionnées.
Pour en savoir plus sur la façon dont cet article a été rédigé, veuillez consulter le Base de données complète de médecines naturelles méthodologie.
- Anderson TJ, Grégoire J, Pearson GJ, et al. Lignes directrices 2016 de la Société canadienne de cardiologie pour la prise en charge de la dyslipidémie pour la prévention des maladies cardiovasculaires chez l'adulte. Can J Cardiol. 2016 ; 32 : 1263-1282. Voir résumé.
- Stone NJ, Robinson JG, Lichtenstein AH, et al. Ligne directrice 2013 de l'ACC/AHA sur le traitement du cholestérol sanguin pour réduire le risque cardiovasculaire athéroscléreux chez l'adulte : rapport du groupe de travail de l'American College of Cardiology/American Heart Association sur les lignes directrices de pratique. J Am Coll Cardiol 2014;63:2889-934. Voir résumé.
- Lloyd-Jones DM, Morris PB, Ballantyne CM, et al. 2016 Décision de consensus d'experts de l'ACC sur le rôle des thérapies sans statine pour la réduction du cholestérol LDL dans la gestion du risque de maladie cardiovasculaire athéroscléreuse : un rapport du groupe de travail de l'American College of Cardiology sur les documents de consensus d'experts cliniques. J Am Coll de Cardiol 2016;68:92-125. Voir résumé.
- Montserrat-de la Paz S, Lopez S, Bermudez B, et al. Effets de la niacine à libération immédiate et des acides gras alimentaires sur le statut insulinique et lipidique aigu chez les personnes atteintes du syndrome métabolique. J Sci Food Agric 2018; 98: 2194-200. Voir résumé.
- Jenkins DJA, Spence JD, Giovannucci EL, et al. Vitamines et minéraux supplémentaires pour la prévention et le traitement des MCV. J Am Coll Cardiol 2018;71:2570-84. Voir résumé.
- Sahebkar A, Reiner Z, Simental-Mendia LE, Ferretti G, Cicero AF. Effet de la niacine à libération prolongée sur les taux plasmatiques de lipoprotéines (a): Une revue systématique et une méta-analyse d'essais randomisés contrôlés par placebo. Métabolisme. Novembre 2016 ; 65 : 1664-78. Voir résumé.
- Gaynon MW, Paulus YM, Rahimy E, Alexander JL, Mansour SE. Effet de la niacine orale sur l'occlusion de la veine centrale de la rétine. Graefes Arch Clin Exp Ophtalmol. 2017 juin ; 255 : 1085-92. Voir résumé.
- Schandelmaier S, Briel M, Saccilotto R, Olu KK, Arpagaus A, Hemkens LG, Nordmann AJ. Niacine pour la prévention primaire et secondaire des événements cardiovasculaires. Cochrane Database Syst Rév. 2017 juin 14;6:CD009744. Voir résumé.
- Lin C, Grandinetti A, Shikuma C, et al. Les effets de la niacine à libération prolongée sur les concentrations de sous-particules de lipoprotéines chez les patients infectés par le VIH. Hawaï J Med Santé publique. 2013 avril ; 72 : 123-7. Voir résumé.
- Scoffone HM, Krajewski M, Zorca S, et al. Effet de la niacine à libération prolongée sur les lipides sériques et sur la fonction endothéliale chez les adultes atteints d'anémie falciforme et de faibles taux de cholestérol à lipoprotéines de haute densité. Suis J Cardiol. 1 novembre 2013 ; 112 : 1499-504. Voir résumé.
- Brunner G, Yang EY, Kumar A, et al. L'effet de la modification des lipides sur la maladie artérielle périphérique après un essai d'intervention endovasculaire (ELIMIT). Athérosclérose. 2013 décembre ; 213 : 371-7. Voir résumé.
- Goldie C, Taylor AJ, Nguyen P, McCoy C, Zhao XQ, Preiss D. La thérapie à la niacine et le risque de diabète d'apparition récente : une méta-analyse d'essais contrôlés randomisés. Cœur. Février 2016 ; 102 : 198-203. Voir résumé.
- PL Detail-Document, Rôle des non-statines pour la dyslipidémie. Lettre du pharmacien/Lettre du prescripteur. Juin 2016;32:320601.
- Teo KK, Goldstein LB, Chaitman BR, Grant S, Weintraub WS, Anderson DC, Sila CA, Cruz-Flores S, Padley RJ, Kostuk WJ, Boden WE ; Chercheurs AIM-HIGH. Thérapie à la niacine à libération prolongée et risque d'accident vasculaire cérébral ischémique chez les patients atteints de maladie cardiovasculaire : l'essai d'intervention sur l'athérothrombose dans le syndrome métabolique avec un faible taux de HDL/des triglycérides élevés : impact sur les résultats de santé mondiaux (AIM-HIGH). Coup. 2013 octobre ; 44 : 2688-93. Voir résumé.
- Shearer GC, Pottala JV, Hansen SN, Brandenburg V, Harris WS. Effets de la niacine sur ordonnance et des acides gras oméga-3 sur les lipides et la fonction vasculaire dans le syndrome métabolique : un essai contrôlé randomisé. J Lipid Res. 2012 novembre ; 53 : 2429-35. Voir résumé.
- Sazonov V, Maccubbin D, Sisk CM, Canner PL. Effets de la niacine sur l'incidence de nouveaux cas de diabète et d'événements cardiovasculaires chez les patients présentant une normoglycémie et une glycémie à jeun altérée. Int J Clin Pract. 2013 avril ; 67 : 297-302. Voir résumé.
- Philpott AC, Hubacek J, Sun YC, Hillard D, Anderson TJ. La niacine améliore le profil lipidique mais pas la fonction endothéliale chez les patients atteints de maladie coronarienne sous traitement par statines à haute dose. Athérosclérose. 2013 février ; 226 : 453-8. Voir résumé.
- Loebl T, Raskin S. Un nouveau rapport de cas: épisode psychotique maniaque aigu après traitement à la niacine. J Neuropsychiatrie Clin Neurosci. 2013 Automne;25:E14. Voir résumé.
- Lavigne PM, Karas RH. L'état actuel de la niacine dans la prévention des maladies cardiovasculaires : une revue systématique et une méta-régression. J Am Coll Cardiol. 29 janvier 2013;61:440-6. Voir résumé.
- Lakey WC, Greyshock N, Guyton JR. Effets indésirables des xanthomes du tendon d'Achille chez trois patients hypercholestérolémiques après intensification du traitement par la niacine et les chélateurs des acides biliaires. J Clin Lipidol. 2013 mars-avril;7:178-81. Voir résumé.
- Kei A, Liberopoulos EN, Mikhailidis DP, Elisaf M. Comparaison du passage à la dose la plus élevée de rosuvastatine vs acide nicotinique en supplément vs fénofibrate en supplément pour la dyslipidémie mixte. Int J Clin Pract. 2013 mai;67:412-9. Voir résumé.
- Keene D, Price C, Shun-Shin MJ, Francis DP. Effet sur le risque cardiovasculaire des traitements médicamenteux ciblés par les lipoprotéines de haute densité niacine, fibrates et inhibiteurs de la CETP : méta-analyse d'essais contrôlés randomisés incluant 117 411 patients. BMJ. 18 juillet 2014 : 349 : g4379. Voir résumé.
- He YM, Feng L, Huo DM, Yang ZH, Liao YH. Avantages et inconvénients de la niacine et de son analogue pour les patients en dialyse rénale : une revue systématique et une méta-analyse. Int Urol Néphrol. Février 2014 ; 46 : 433-42. Voir résumé.
- Guyton JR, Fazio S, Adewale AJ, Jensen E, Tomassini JE, Shah A, Tershakovec AM. Effet de la niacine à libération prolongée sur le diabète d'apparition récente chez les patients hyperlipidémiques traités par ézétimibe/simvastatine dans un essai contrôlé randomisé. Traitements diabétiques. Avr 2012 ; 35 : 857-60. Voir résumé.
- Davidson MH, Rooney M, Pollock E, Drucker J, Choy Y. Effet du colesevelam et de la niacine sur le cholestérol à lipoprotéines de basse densité et le contrôle glycémique chez les sujets atteints de dyslipidémie et d'altération de la glycémie à jeun. J Clin Lipidol. 2013 septembre-octobre ; 7 : 423-32. Voir résumé.
- Bassan M. Un cas pour la niacine à libération immédiate. Coeur Poumon. 2012 janvier-fév; 41:95-8. Voir résumé.
- Aramwit P, Srisawadwong R, Supasyndh O. Efficacité et sécurité de l'acide nicotinique à libération prolongée pour réduire le phosphore sérique chez les patients hémodialysés. J Néphrol. 2012 mai-juin;25:354-62. Voir résumé.
- Ali EH, McJunkin B, Jubelirer S, Hood W. La coagulopathie induite par la niacine comme manifestation d'une lésion hépatique occulte. W V Med J. 2013 jan-fév;109:12-4 Voir le résumé.
- Urberg, M., Benyi, J. et John, R. Effets hypocholestérolémiants de la supplémentation en acide nicotinique et en chrome. J Fam.Pratique. 1988;27:603-606. Voir résumé.
- Hendrix, CR, Housh, TJ, Mielke, M., Zuniga, JM, Camic, CL, Johnson, GO, Schmidt, RJ et Housh, DJ Effets aigus d'un supplément contenant de la caféine sur la force et la durée du développé couché et de l'extension des jambes à l'épuisement pendant le cycle ergométrique. J Strength.Cond.Res 2010;24:859-865. Voir résumé.
- Figge HL, Figge J, Souney PF et al. Comparaison de l'excrétion d'acide nicotinurique après ingestion de deux préparations d'acide nicotinique à libération contrôlée chez l'homme. J Clin Pharmacol. 1988 décembre ; 28 : 1136-40. Voir résumé.
- Mrochek JE, Jolley RL, Young DS, Turner WJ. Réponse métabolique des humains à l'ingestion d'acide nicotinique et de nicotinamide. Clin Chem. 1976;22:1821-7. Voir résumé.
- Neuvonen PJ, Roivas L, Laine K, Sundholm O. La biodisponibilité des formulations d'acide nicotinique à libération prolongée. Frère J Clin Pharmacol. 1991;32:473-6. Voir résumé.
- Menon RM, Adams MH, González MA, Tolbert DS, Leu JH, Cefali EA. Pharmacocinétique plasmatique et urinaire de la niacine et de ses métabolites à partir d'une formulation de niacine à libération prolongée. Int J Clin Pharmacol Ther. 2007;45:448-54. Voir résumé.
- Karpe F, Frayn KN. Le récepteur de l'acide nicotinique - un nouveau mécanisme pour un ancien médicament. Lancette. 2004;363:1892-4. Voir résumé.
- Cas S, Smith SJ, Zheng YW, et al. Identification d'un gène codant pour une acyl CoA:diacylglycérol acyltransférase, une enzyme clé dans la synthèse des triacylglycérols. Proc Natl Acad Sci U S A. 1998 ; 95 : 13018-23. Voir résumé.
- Ganji SH, Tavintharan S, Zhu D, Xing Y, Kamanna VS, Kashyap ML. La niacine inhibe de manière non compétitive l'activité DGAT2 mais pas DGAT1 dans les cellules HepG2. J Lipid Res. 2004;45:1835-45. Voir résumé.
- Tornvall P, Hamsten A, Johansson J, Carlson LA. Normalisation de la composition des lipoprotéines de très basse densité dans l'hypertriglycéridémie par l'acide nicotinique. Athérosclérose. 1990;84(2-3):219-27. Voir résumé.
- Morgan JM, Capuzzi DM, Baksh RI, et al. Effets de la niacine à libération prolongée sur la distribution des sous-classes de lipoprotéines. Suis J Cardiol. 2003;91:1432-6. Voir résumé.
- Jin FY, Kamanna VS, Kashyap ML. La niacine diminue l'élimination de l'apolipoprotéine A-I des lipoprotéines de haute densité mais pas de l'ester de cholestérol par les cellules Hep G2. Implication pour le transport inverse du cholestérol. Arterioscler Thromb Vasc Biol. 1997;17:2020-8. Voir résumé.
- Vincent JE, Zijlstra FJ. L'acide nicotinique inhibe la synthèse du thromboxane dans les plaquettes. Prostaglandines. 1978;15:629-36. Voir résumé.
- Datta S, Das DK, Engelman RM et al. Préservation myocardique renforcée par l'acide nicotinique, un composé antilipolytique : mécanisme d'action. Res Cardiol de base. 1989;84:63-76. Voir résumé.
- Turjman N, Cardamone A, Gotterer GS, Hendrix TR. Effet de l'acide nicotinique sur le mouvement des fluides induits par le choléra et les flux de sodium unidirectionnels dans le jéjunum de lapin. Johns Hopkins Med J. 1980;147:209-11. Voir résumé.
- Unna K. Études sur la toxicité et la pharmacologie de l'acide nicotinique. J Pharmacol Exp Ther 1939;65:95-103.
- Brazda FG et Coulson RA. Toxicité de l'acide nicotinique et de certains de ses dérivés. Proc Soc Exp Biol Med 1946;62:19-20.
- Chen KK, Rose CL, Robbins EB. Toxicité de l'acide nicotinique. Proc Soc Exp Biol Med 1938;38:241-245.
- Fraunfelder FW, Fraunfelder FT, Illingworth DR. Effets oculaires indésirables associés au traitement par la niacine. Br J Ophthalmol 1995;79:54-56.
- Litin SC, Anderson CF. Myopathie associée à l'acide nicotinique : à propos de trois cas. Suis J Med. 1989;86:481-3.Voir le résumé.
- Gharavi AG, Diamond JA, Smith DA, Phillips RA. Myopathie induite par la niacine. Suis J Cardiol. 1994;74:841-2. Voir résumé.
- O'REILLY PO, CALLBECK MJ, HOFFER A. Acide nicotinique à libération prolongée (nicospan); effet sur le taux de cholestérol et les leucocytes. Can Med Assoc J. 1959;80:359-62. Voir résumé.
- Terrien TP, Odom L, Mullins CA. Acidose lactique associée à un traitement à la niacine à haute dose. South Med J. 1991;84:496-7. Voir résumé.
- Brun WV. Niacine pour les troubles lipidiques. Indications, efficacité et sécurité. Postgrad Med. Août 1995 ; 98 : 185-9, 192-3. Voir résumé.
- Windler E, Zyriax BC, Bamberger C, Rinninger F, Beil FU. Stratégies actuelles et avancées récentes dans le traitement de l'hypercholestérolémie. Atheroscler Suppl. 2009;10:1-4. Voir résumé.
- Kaijser L, Eklund B, Olsson AG, Carlson LA. Dissociation des effets de l'acide nicotinique sur la vasodilatation et la lipolyse par un inhibiteur de la synthèse des prostaglandines, l'indométacine, chez l'homme. Med Biol. 1979;57:114-7. Voir résumé.
- Eklund B, Kaijser L, Nowak J, Wennmalm A. Les prostaglandines contribuent à la vasodilatation induite par l'acide nicotinique. Prostaglandines. 1979;17:821-30. Voir résumé.
- Andersson RG, Aberg G, Brattsand R, Ericsson E, Lundholm L. Études sur le mécanisme de flush induit par l'acide nicotinique. Acta Pharmacol Toxicol (Copenh). 1977 juillet;41:1-10. Voir résumé.
- Morgan JM, Capuzzi DM, Guyton JR, et al. Effet du traitement de Niaspan, une niacine à libération contrôlée, chez les patients atteints d'hypercholestérolémie : un essai contrôlé par placebo. J Cardiovasc Pharmacol Ther. 1996 ; 1:195-202. Voir résumé.
- Aronov DM, Keenan JM, Akhmedzhanov NM, et al. Essai clinique de niacine à libération prolongée sur matrice de cire dans une population russe souffrant d'hypercholestérolémie. Arch Fam Med. 1996;5:567-75. Voir résumé.
- Goldberg A, Alagona P Jr, Capuzzi DM et al. Efficacité et sécurité à doses multiples d'une forme à libération prolongée de niacine dans la gestion de l'hyperlipidémie. Suis J Cardiol. 2000;85:1100-5. Voir résumé.
- Smith DT, Ruffin JM et Smith SG. Pellagre traitée avec succès à l'acide nicotinique : à propos d'un cas. JAMA 1937;109:2054-2055.
- Fouts PJ, Helmer OM, Lepkovsky S, et al. Traitement de la pellagre humaine avec de l'acide nicotinique. Proc Soc Exp Biol Med 1937;37:405-407.
- Brown BG, Bardsley J, Poulin D, et al. Une trithérapie à dose modérée avec de la niacine, de la lovastatine et du colestipol pour réduire le cholestérol à lipoprotéines de basse densité < 100 mg/dl chez les patients atteints d'hyperlipidémie et de maladie coronarienne. Suis J Cardiol. 1997;80:111-5. Voir résumé.
- Interdiction de TA. Psychiatrie académique et industrie pharmaceutique. Prog Neuropsychopharmacol Biol Psychiatrie. 2006 mai ; 30 : 429-41. Voir le résumé.
- DJ Lanska. Chapitre 30 : aspects historiques des troubles neurologiques majeurs dus à une carence vitaminique : les vitamines B hydrosolubles. Handb Clin Neurol. 2010;95:445-76. Voir résumé.
- Berge KG, Canner PL. Projet de médicament coronarien : expérience avec la niacine. Groupe de recherche du projet sur les médicaments coronariens. Eur J Clin Pharmacol. 1991;40 Suppl 1:S49-51. Voir résumé.
- Aucun auteur répertorié. Clofibrate et niacine dans les maladies coronariennes. JAMA. 27 janvier 1975;231:360-81. Voir résumé.
- Henkin Y, Oberman A, Hurst DC, Segrest JP. Niacine revisitée : observations cliniques sur un médicament important mais sous-utilisé. Suis J Med. 1991;91:239-46. Voir résumé.
- Henkin Y, Johnson KC, Segrest JP. Réexposition à la niacine cristalline après une hépatite d'origine médicamenteuse due à la niacine à libération prolongée. JAMA. 1990;264:241-3. Voir résumé.
- Etchason JA, Miller TD, Squires RW, et al. Hépatite induite par la niacine : un effet secondaire potentiel avec la niacine à libération prolongée à faible dose. Mayo Clin Proc. 1991;66:23-8. Voir résumé.
- Shakir KM, Kroll S, Aprill BS, Drake AJ 3e, Eisold JF. L'acide nicotinique diminue les taux sériques d'hormones thyroïdiennes tout en maintenant un état euthyroïdien. Mayo Clin Proc. 1995;70:556-8. Voir résumé.
- Drinka PJ. Altérations des tests de la fonction thyroïdienne et hépatique associées aux préparations de niacine à libération prolongée. Mayo Clin Proc. 1992;67:1206. Voir résumé.
- Cashin-Hemphill L, Spencer CA, Nicoloff JT, et al. Altérations des indices hormonaux thyroïdiens sériques avec le traitement par colestipol-niacine. Ann Stagiaire Med. 1987;107:324-9. Voir résumé.
- Dunn RT, Ford MA, Rindone JP, Kwiecinski FA. L'aspirine et l'ibuprofène à faible dose réduisent les réactions cutanées après l'administration de niacine. Suis J Ther. 1995;2 :478-480. Voir résumé.
- Litin SC, Anderson CF. Myopathie associée à l'acide nicotinique : à propos de trois cas. Suis J Med. 1989;86:481-3. Voir résumé.
- Hexeberg S, Retterstøl K. [Hypertriglycéridémie - diagnostic, risque et traitement]. Tidsskr Nor Laegeforen. 2004;124:2746-9. Voir résumé.
- Garnett WR. Interactions avec les inhibiteurs de l'hydroxyméthylglutaryl-coenzyme A réductase. Suis J Health Syst Pharm. 1995;52:1639-45. Voir résumé.
- Gadegbeku CA, Dhandayuthapani A, Shrayyef MZ, Egan BM. Effets hémodynamiques de la perfusion d'acide nicotinique chez les sujets normotendus et hypertendus. Suis J Hypertens. 2003;16:67-71. Voir résumé.
- O'Brien T, Silverberg JD, Nguyen TT. Toxicité induite par l'acide nicotinique associée à une cytopénie et à une diminution des taux de globuline liant la thyroxine. Mayo Clin Proc. 1992;67:465-8. Voir résumé.
- Dearing BD, Lavie CJ, Lohmann TP, Genton E. Déficit de synthèse du facteur de coagulation induit par la niacine avec coagulopathie. Stagiaire Arch Med. 1992;152:861-3. Voir résumé.
- Sampathkumar K, Selvam M, Sooraj YS, Gowthaman S, Ajeshkumar RN. Acide nicotinique à libération prolongée - un nouvel agent oral pour le contrôle du phosphate. Int Urol Néphrol. 2006;38:171-4. Voir résumé.
- Ng CF, Lee CP, Ho AL, Lee VW. Effet de la niacine sur la fonction érectile chez les hommes souffrant de dysfonction érectile et de dyslipidémie. J Sexe Med. 2011;8:2883-93. Voir résumé.
- Duggal JK, Singh M, Attri N, et al. Effet de la thérapie à la niacine sur les résultats cardiovasculaires chez les patients atteints de maladie coronarienne. J Cardiovasc Pharmacol Ther. 2010;15:158-66. Voir résumé.
- Carlson LA, Rosenhamer G. Réduction de la mortalité dans l'étude de prévention secondaire des cardiopathies ischémiques de Stockholm par un traitement combiné avec du clofibrate et de l'acide nicotinique. Acta Med Scand. 1988;223:405-18. Voir résumé.
- Blankenhorn DH, Nessim SA, Johnson RL, et al. Effets bénéfiques du traitement combiné colestipol-niacine sur l'athérosclérose coronarienne et les pontages veineux coronariens. JAMA. 1987;257:3233-40. Voir résumé.
- Mack WJ, Selzer RH, Hodis HN, et al. Réduction d'un an et analyse longitudinale de l'épaisseur intima-média carotidienne associée au traitement par colestipol/niacine. Coup. 1993;24:1779-83. Voir résumé.
- Blankenhorn DH, Selzer RH, Crawford DW, et al. Effets bénéfiques du traitement par colestipol-niacine sur l'artère carotide commune. Réduction à deux et quatre ans de l'épaisseur intima-média mesurée par ultrasons. Circulation. 1993;88:20-8. Voir résumé.
- Brown BG, Zambon A, Poulin D, et al. Utilisation de niacine, de statines et de résines chez les patients atteints d'hyperlipidémie combinée. Suis J Cardiol. 1998;81(4A):52B-59B. Voir résumé.
- Brown G, Albers JJ, Fisher LD, et al. Régression de la maladie coronarienne à la suite d'un traitement hypolipémiant intensif chez les hommes présentant des taux élevés d'apolipoprotéine B. N Engl J Med. 1990;323:1289-98. Voir résumé.
- Bruckert E, Labreuche J, Amarenco P. Méta-analyse de l'effet de l'acide nicotinique seul ou en association sur les événements cardiovasculaires et l'athérosclérose. Athérosclérose. 2010;210:353-61. Voir résumé.
- Spies TD, Grant JM, Stone RE, et al. Observations récentes sur le traitement de six cents pellagrines avec un accent particulier sur l'utilisation de l'acide nicotinique en prophylaxie. Sud de la Méditerranée J 1938; 31:1231.
- Malfait P, Moren A, Dillon JC, et al. Une épidémie de pellagre liée à des changements dans la niacine alimentaire chez les réfugiés mozambicains au Malawi. Int J Epidémiol. 1993;22:504-11. Voir résumé.
- Gerber MT, Mondy KE, Yarasheski KE, et al. Niacine chez les personnes infectées par le VIH atteintes d'hyperlipidémie recevant un puissant traitement antirétroviral. Clin Infect Dis. 2004;39:419-25. Voir résumé.
- Le député Dubé, Wu JW, le juge Aberg, et al. Sécurité et efficacité de la niacine à libération prolongée pour le traitement de la dyslipidémie chez les patients infectés par le VIH : étude A5148 du groupe d'essais cliniques sur le SIDA. Antivir Ther. 2006;11:1081-9. Voir résumé.
- Balasubramanyam A, Coraza I, Smith EO, et al. L'association de la niacine et du fénofibrate avec des changements de mode de vie améliore la dyslipidémie et l'hypoadiponectinémie chez les patients VIH sous traitement antirétroviral : résultats d'un essai contrôlé randomisé. J Clin Endocrinol Metab. 2011;96 :2236-47. Voir résumé.
- Elam MB, Hunninghake DB, Davis KB, et al. Effet de la niacine sur les taux de lipides et de lipoprotéines et le contrôle glycémique chez les patients atteints de diabète et de maladie artérielle périphérique : l'étude ADMIT : un essai randomisé. Essai d'intervention multiple sur les maladies artérielles. JAMA. 2000;284:1263-70. Voir résumé.
- Charland SL, Malone DC. Prédiction de la réduction du risque d'événements cardiovasculaires dus aux changements lipidiques associés au traitement de la dyslipidémie à haute puissance. Curr Med Res Opin. 2010;26:365-75. Voir résumé.
- Goldberg AC. Une méta-analyse d'études contrôlées randomisées sur les effets de la niacine à libération prolongée chez les femmes. Suis J Cardiol. 2004;94:121-4. Voir résumé.
- Maes BD, Hiele MI, Geypens BJ, et al. Modulation pharmacologique de la vitesse de vidange gastrique des solides telle que mesurée par le test respiratoire à l'acide octanoïque marqué au carbone : influence de l'érythromycine et de la propanthéline. Gut 1994;35:333-7. Voir résumé.
- Déclaration de la FDA sur l'essai AIM-HIGH. http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm256841.htm. (Consulté le 3 juin 2011).
- Nouvelles du NIH. Le NIH arrête l'essai clinique sur le traitement combiné du cholestérol. 26 mai 2011.http://www.nih.gov/news/health/may2011/nhlbi-26.htm. (Consulté le 3 juin 2011).
- PL Detail-Document, Niacin Plus Statine pour réduire le risque cardiovasculaire : étude AIM-HIGH. Lettre du pharmacien/Lettre du prescripteur. juillet 2011.
- Karthikeyan K, Thappa DM. Pellagre et peau. Int J Dermatol 2002;41:476-81. Voir résumé.
- Hendricks WM. Pellagre et dermatoses pellagrelike : étiologie, diagnostic différentiel, dermatopathologie et traitement. Semin Dermatol 1991;10:282-92. Voir résumé.
- Bingham LG, Verma SB. Une éruption photodistribuée. (Examen d'auto-évaluation de l'Académie américaine de dermatologie). J Am Acad Dermatol 2005;52:929-32.
- Nahata MC. Chloramphénicol. Dans : Evans WE, Schentag JJ, Jusko WJ (eds). Pharmacocinétique appliquée : Principes de pharmacovigilance thérapeutique. 3e éd., Vancouver, WA : Applied Therapeutics, Inc., 1992.
- Ding RW, Kolbe K, Merz B, et al. Pharmacocinétique de l'interaction acide nicotinique-acide salicylique. Clin Pharmacol Ther 1989;46:642-7. Voir résumé.
- Lyon VB, juge Fairley. Pellagre induite par les anticonvulsivants. J Am Acad Dermatol 2002;46:597-9. Voir résumé.
- Kaur S, Goraya JS, Thami GP, Kanwar AJ. Dermatite pellagreuse induite par la phénytoïne (lettre). Pédiatre Derm 2002;19:93. Voir résumé.
- Wood B, Rademaker M, Oakley A, Wallace J. Pellagra chez une femme utilisant des remèdes alternatifs. Australas J Dermatol 1998;39:42-4. Voir résumé.
- Bender DA, Russell-Jones R. Pellagre induite par l'isoniazide malgré la supplémentation en vitamine B6 (lettre). Lancet 1979;2:1125-6. Voir résumé.
- Stevens H, Ostlere L, Begent R, et al. Pellagre secondaire au 5-fluorouracile. Br J Dermatol 1993; 128 : 578-80. Voir résumé.
- Swash M, Roberts AH. Encéphalopathie pellagre-like réversible avec éthionamide et cyclosérine. Tubercule 1972;53:132. Voir résumé.
- Brooks-Hill RW, Bishop ME, Vellend H. Pellagra-like encéphalopathie compliquant un schéma thérapeutique multiple pour le traitement de l'infection pulmonaire due à Mycobacterium avium-intracellulare (lettre). Am Rev Resp Dis 1985;131:476. Voir résumé.
- Bender DA, Earl CJ, Lees AJ. Déplétion en niacine chez les patients parkinsoniens traités par L-dopa, bensérazide et carbidopa. Clinical Sci 1979;56:89-93. . Voir résumé.
- Ludwig GD, Blanc DC. Pellagre induite par la 6-mercaptopurine. Clin Res 1960;8:212.
- Stratigos JD, Katsambas A. Pellagra : une maladie toujours existante. Br J Dermatol 1977;96:99-106. Voir résumé.
- Jarrett P, Duffill M, Oakley A, Smith A. Pellagra, azathioprine et maladie intestinale inflammatoire. Clin Exp Dermatol 1997;22:44-5. Voir résumé.
- Informations sur le produit : Niaspan. Kos Pharmaceuticals. Cranbury, New Jersey. 2005. Disponible sur www.niaspan.com/professional/content/pdfs/productinfo.pdf. (Consulté le 3 mars 2006).
- Schwab RA, Bachhuber BH. Délire et acidose lactique causés par la coingestion d'éthanol et de niacine. Am J Emerg Med 1991;9:363-5. Voir résumé.
- C'est à MK. Avancées dans la compréhension et la gestion de la dyslipidémie : utilisation de thérapies à base de niacine. Am J Health-Syst Pharm 2003;60(suppl 2):s15-21. Voir résumé.
- Reaven P, Witztum JL. Lovastatine, acide nicotinique et rhabdomyolyse (lettre). Ann Int Med 1988;109:597-8. Voir résumé.
- Rockwell KA. Interaction potentielle entre la niacine et la nicotine transdermique (lettre). Ann Pharmacother 1993;27:1283-4. Voir résumé.
- Gillman MA, Sandyk R. Carence en acide nicotinique induite par le valproate de sodium (lettre). S Afr Med J 1984;65:986. Voir résumé.
- Papa CM. Niacinamide et acanthosis nigricans (lettre). Arch Dermatol 1984; 120 : 1281. Voir résumé.
- Morris MC, Evans DA, Bianias JL, et al. Niacine alimentaire et risque de maladie d'Alzheimer incidente et de déclin cognitif. J Neurol Neurosurg Psychiatry 2004;75:1093-99. Voir résumé.
- McKenney J. Nouvelles perspectives sur l'utilisation de la niacine dans le traitement des troubles lipidiques. Arch Intern Med 2004;164:697-705. Voir résumé.
- Augmentation de l'utilisation des HDL et de la niacine. Lettre du pharmacien/Lettre du prescripteur 2004;20:200504.
- Hoskin PJ, Stratford MR, Saunders MI, et al. Administration de nicotinamide pendant le graphique : pharmacocinétique, escalade de dose et toxicité clinique. Int J Radiat Oncol Biol Phys 1995;32:1111-9. Voir résumé.
- Miralbell R, Mornex F, Greiner R, et al. Radiothérapie accélérée, carbogène et nicotinamide dans le glioblastome multiforme : rapport de l'essai 22933 de l'Organisation européenne pour la recherche et le traitement du cancer. J Clin Oncol 1999;17:3143-9. Voir résumé.
- Anon. Monographie Niacinamide. Alt Med Rev 2002;7:525-9. Voir résumé.
- Schwartz ML. Hyperglycémie sévère réversible à la suite d'un traitement à la niacine. Arch Int Med 1993;153:2050-2. Voir résumé.
- Kahn SE, Beard JC, Schwartz MW et al. Augmentation de la capacité de sécrétion des lymphocytes B en tant que mécanisme d'adaptation des îlots à la résistance à l'insuline induite par l'acide nicotinique. Diabète 1989;38:562-8. Voir résumé.
- Rader JI, Calvert RJ, Hathcock JN. Toxicité hépatique des préparations non modifiées et à libération prolongée de niacine. Am J Med 1992;92:77-81. Voir résumé.
- Figge HL, Figge J, Souney PF et al. Acide nicotinique : une revue de son utilisation clinique dans le traitement des troubles lipidiques. Pharmacothérapie 1988;8:287-94. Voir résumé.
- Baies HE, Dujovne CA. Interactions médicamenteuses des médicaments altérant les lipides. Drug Saf 1998;19:355-71. Voir résumé.
- Vannucchi H, Moreno FS. Interaction du métabolisme de la niacine et du zinc chez les patients atteints de pellagre alcoolique. Suis J Clin Nutr 1989;50:364-9. Voir résumé.
- Urberg M, Zemel MB. Preuve d'une synergie entre le chrome et l'acide nicotinique dans le contrôle de la tolérance au glucose chez les personnes âgées. Métabolisme 1987;36:896-9. Voir résumé.
- Cheung MC, Zhao XQ, Chait A, et al. Les suppléments antioxydants bloquent la réponse du HDL au traitement par la simvastatine-niacine chez les patients atteints de maladie coronarienne et de faible HDL. Arterioscler Thromb Vasc Biol 2001;21:1320-6. Voir résumé.
- Chesney CM, Elam MB, Herd JA, et al. Effet de la niacine, de la warfarine et de la thérapie antioxydante sur les paramètres de coagulation chez les patients atteints de maladie artérielle périphérique dans l'essai d'intervention multiple sur la maladie artérielle (ADMIT). Am Heart J 2000;140:631-6.. Voir le résumé.
- Wink J, Giacoppe G, King J. Effet de la naïcine à très faible dose sur les lipoprotéines de haute densité chez les patients suivant un traitement par statine à long terme. Am Heart J 2002;143:514-8.. Voir le résumé.
- Wolfe ML, Vartanian SF, Ross JL, et al. Sécurité et efficacité de Niaspan lorsqu'il est ajouté séquentiellement à une statine pour le traitement de la dyslipidémie. Am J Cardiol 2001;87:476-9,A7.. Voir le résumé.
- Brown BG, Zhao XQ, Chait A, et al. Simvastatine et niacine, vitamines antioxydantes, ou l'association pour la prévention des maladies coronariennes. N Engl J Med 2001;345:1583-93. Voir résumé.
- Cumming RG, Mitchell P, Smith W. Régime alimentaire et cataracte : l'étude Blue Mountains Eye. Ophtalmologie 2000;10:450-6. Voir résumé.
- Kuroki F, Iida M, Tominaga M, et al. Statut multivitaminé dans la maladie de Crohn. Corrélation avec l'activité de la maladie. Dig Dis Sci 1993;38:1614-8. Voir résumé.
- Conseil de l'alimentation et de la nutrition, Institut de médecine. Apports nutritionnels de référence pour la thiamine, la riboflavine, la niacine, la vitamine B6, le folate, la vitamine B12, l'acide pantothénique, la biotine et la choline. Washington, DC : National Academy Press, 2000. Disponible sur : http://books.nap.edu/books/0309065542/html/.
- Site Web de l'Association américaine de diététique. Disponible sur : www.eatright.org/adap1097.html (consulté le 16 juillet 1999).
- Lal SM, Hewett JE, Petroski GF et al. Effets de l'acide nicotinique et de la lovastatine chez les patients transplantés rénaux : un essai croisé prospectif, randomisé et ouvert. Suis J Kidney Dis 1995;25:616-22. Voir résumé.
- Guyton JR, Goldberg AC, Kreisberg RA, et al. Efficacité du dosage une fois par nuit de niacine à libération prolongée seule et en association pour l'hypercholestérolémie. Suis J Cardiol 1998;82:737-43. Voir résumé.
- Vega GL, Grundy SM. Réponses des lipoprotéines au traitement par la lovastatine, le gemfibrozil et l'acide nicotinique chez les patients normolipidémiques atteints d'hypoalphalipoprotéinémie. Arch Intern Med 1994;154:73-82. Voir résumé.
- Vacek JL, Dittmeier G, Chiarelli T, et al. Comparaison de la lovastatine (20 mg) et de l'acide nicotinique (1,2 g) avec l'un ou l'autre des médicaments seuls pour l'hyperlipoprotéinémie de type II. Am J Cardiol 1995;76:182-4. Voir résumé.
- Illingworth DR, Stein EA, Mitchel YB, et al. Effets comparatifs de la lovastatine et de la niacine dans l'hypercholestérolémie primaire. Un essai prospectif. Arch Intern Med 1994;154:1586-95. Voir résumé.
- Pozzilli P, Browne PD, Kolb H. Méta-analyse du traitement à la nicotinamide chez les patients atteints de DID d'apparition récente. Les essais sur la nicotinamide. Soins du diabète 1996;19:1357-63. Voir résumé.
- Johansson JO, Egberg N, Asplund-Carlson A, Carlson LA. Le traitement à l'acide nicotinique modifie favorablement l'équilibre fibrinolytique et diminue le fibrinogène plasmatique chez les hommes hypertriglycéridémiques. J Cardiovasc Risk 1997;4:165-71. Voir résumé.
- Rabbani GH, Butler T, Bardhan PK, Islam A. Réduction de la perte de liquide dans le choléra par l'acide nicotinique : un essai contrôlé randomisé. Lancet 1983; 2:1439-42. Voir résumé.
- Programme national d'éducation au cholestérol. Abaissement du cholestérol chez le patient atteint d'une maladie coronarienne. 1997. Disponible sur : http://www.vidyya.com/pdfs/1225cholesterol.pdf. (Consulté le 26 mai 2016).
- Darvay A, Basarab T, McGregor JM, Russell-Jones R. La pellagre induite par l'isoniazide malgré la supplémentation en pyridoxine. Clin Exp Dermatol 1999;24:167-9. Voir résumé.
- Ishii N, encéphalopathie Nishihara Y. Pellagra chez les patients tuberculeux: sa relation avec le traitement à l'isoniazide. J Neurol Neurosurg Psychiatry 1985;48:628-34. Voir résumé.
- Société américaine des pharmaciens du système de santé. Énoncé de position thérapeutique de l'ASHP sur l'utilisation sûre de la niacine dans la gestion des dyslipidémies. Am J Health Syst Pharm 1997;54:2815-9. Voir résumé.
- Leighton RF, Gordon NF, Small GS et al. Douleurs dentaires et gingivales comme effets secondaires du traitement à la niacine. Poitrine 1998;114:1472-4. Voir résumé.
- Garg A, Grundy SM. L'acide nicotinique comme traitement de la dyslipidémie dans le diabète sucré non insulino-dépendant. JAMA 1990;264:723-6. Voir résumé.
- Crouse JR III. Nouveaux développements dans l'utilisation de la niacine pour le traitement de l'hyperlipidémie : nouvelles considérations dans l'utilisation d'un ancien médicament. Coron Artery Dis 1996;7:321-6. Voir résumé.
- Knopp RH. Profils cliniques de la niacine simple par rapport à la niacine à libération prolongée (Niaspan) et justification physiologique de l'administration nocturne. Am J Cardiol 1998;82:24U-28U;discussion 39U-41U. Voir résumé.
- Knopp RH, Alagona P, Davidson M, et al. Efficacité équivalente d'une forme de niacine à libération prolongée (Niaspan) administrée une fois par nuit par rapport à la niacine simple dans la gestion de l'hyperlipidémie. Métabolisme 1998;47:1097-104. Voir résumé.
- McKenney JM, Proctor JD, Harris S, Chinchili VM. Une comparaison de l'efficacité et des effets toxiques de la niacine à libération prolongée par rapport à celle à libération immédiate chez les patients hypercholestérolémiques. JAMA 1994;271:672-7. Voir résumé.
- Gray DR, Morgan T, Chrétien SD, Kashyap ML. Efficacité et sécurité de la niacine à libération contrôlée chez les vétérans dyslipoprotéinémiques. Ann Intern Med 1994;121:252-8. Voir résumé.
- Capuzzi DM, Guyton JR, Morgan JM, et al. Efficacité et sécurité d'une niacine à libération prolongée (Niaspan) : une étude à long terme. Am J Cardiol 1998;82:74-81;disque. 85U-6U. Voir résumé.
- Jungnickel PW, Maloley PA, Vander Tuin EL, et al. Effet de deux régimes de prétraitement à l'aspirine sur les réactions cutanées induites par la niacine. J Gen Intern Med 1997;12:591-6. Voir résumé.
- Whelan AM, Price SO, Fowler SF, Hainer BL. L'effet de l'aspirine sur les réactions cutanées induites par la niacine. J Fam Pract 1992;34:165-8. Voir résumé.
- Gibbons LW, Gonzalez V, Gordon N, Grundy S. La prévalence des effets secondaires avec l'acide nicotinique à libération régulière et prolongée. Am J Med 1995;99:378-85. Voir résumé.
- Park YK, Sempos CT, Barton CN, et al. Efficacité de l'enrichissement des aliments aux États-Unis : le cas de la pellagre. Am J Public Health 2000;90:727-38. Voir résumé.
- Zhao XQ, Brown BG, Hillger L, et al. Effets d'un traitement hypolipémiant intensif sur les artères coronaires de sujets asymptomatiques présentant une élévation de l'apolipoprotéine B. Circulation 1993;88:2744-53. Voir résumé.
- Canner PL, Berge KG, Wenger NK et al. Mortalité à 15 ans chez les patients du Coronary Drug Project : bénéfice à long terme avec la niacine. J Am Coll Cardiol 1986; 8:1245-55. Voir résumé.
- Guyton JR, Blazing MA, Hagar J, et al. Niacine à libération prolongée vs gemfibrozil pour le traitement des faibles taux de cholestérol à lipoprotéines de haute densité. Groupe d'étude Niaspan-Gemfibrozil. Arch Intern Med 2000;160:1177-84. Voir résumé.
- Zema MJ. Gemfibrozil, acide nicotinique et thérapie combinée chez les patients atteints d'hypoalphalipoprotéinémie isolée : étude randomisée, ouverte et croisée. J Am Coll Cardiol 2000;35:640-6. Voir résumé.
- Knodel LC, Talbert RL. Effets indésirables des médicaments hypolipidémiants. Med Toxicol 1987;2:10-32. Voir résumé.
- Yates AA, Schlicker SA, prétendant CW. Apports nutritionnels de référence : La nouvelle base de recommandations pour le calcium et les nutriments apparentés, les vitamines B et la choline. J Am Diet Assoc 1998;98:699-706. Voir résumé.
- Shils ME, Olson JA, Shike M, Ross AC, éd. Nutrition moderne dans la santé et la maladie. 9e éd. Baltimore, Maryland : Williams et Wilkins, 1999.
- Reimund E. Dermatite induite par la privation de sommeil: soutien supplémentaire de l'épuisement de l'acide nicotinique dans la privation de sommeil. Med Hypotheses 1991;36:371-3. Voir résumé.
- Ioannides-Demos LL, Christophidis N, et al. Implications posologiques d'une interaction clinique entre le jus de pamplemousse et la cyclosporine et les concentrations de métabolites chez les patients atteints de maladies auto-immunes. J Rheumatol 1997;24:49-54. Voir résumé.
- Hardman JG, Limbird LL, Molinoff PB, éd. Goodman et Gillman's The Pharmacological Basis of Therapeutics, 9e éd. New York, NY : McGraw-Hill, 1996.
- Garg R, Malinow MR, Pettinger M, et al. Le traitement à la niacine augmente les taux plasmatiques d'homocystéine. Suis Heart J 1999;138:1082-7. Voir résumé.
- Gruenwald J, Brendler T, Jaenicke C. PDR pour les plantes médicinales. 1ère éd. Montvale, NJ : Medical Economics Company, Inc., 1998.
- McEvoy GK, éd. Informations sur les médicaments AHFS. Bethesda, MD : Société américaine des pharmaciens du système de santé, 1998.